膨大な医療データを武器に――塩野義製薬が挑む新薬開発効率を高めるAI戦略
医療の現場で日々生まれている検査結果などのデータを、新薬開発にどう生かせるのか。塩野義製薬の取り組みを基に、実際の医療データをAIで整理・解析し、研究開発の効率を高めていく最新のデータ活用戦略とその成果を解説する。
この記事は会員限定です。会員登録すると全てご覧いただけます。
主要製薬会社のDX戦略において「リアルワールドデータ」(RWD)の活用が注目されているものの、まだ具体的な活用方法は明確でない。本稿では、塩野義製薬がオーランドで開催された「SAS Innovate 2025」で発表した内容を基に、同社のRWD活用への取り組みとこれまでの成果を紹介する。
製薬業界で注目度の高まる「リアルワールドエビデンス」とは
塩野義製薬は、2023年から3年連続で「DX注目企業」に選ばれている。同社は臨床試験のプログラミング作業を準自動化する製品「AI-SAS」を開発し、2022年以降は社会貢献活動の一環として社外にも提供してきた。現在は、この取り組みを発展させ、リアルワールドエビデンス(RWE:Real World Evidence)の活用にも注力している。
RWEとは、リアルワールドデータ(RWD:Real World Data)を解析して得られる医薬品の効果に関するエビデンスであり、診療行為から収集された医療ビッグデータを匿名化した上で活用するため、従来の臨床試験よりも患者の実態に即した知見を得られる点が特徴だ。主なデータソースは電子カルテやレセプト(診療報酬明細書)、DPC(Diagnosis Procedure Combination)だが、最近は健康診断データやウェアラブルデバイス情報も組み合わせた解析が注目されている。
国内では、厚生労働省が限定的に提供するRWDの他、JMDCやエムスリー、メディカル・データ・ビジョン(MDV)などのデータプロバイダーが、匿名化したRWDを提供している。さらに、機械学習やAIなど解析技術の進歩により、RWD解析を通じた新薬開発の効率化も期待されている。
RWD解析からRWEを創出するプロセスは、まずRWDを調達し、試験実施計画書(プロトコール)などの解析文書を作成して解析する。解析結果は論文としてまとめられ、査読を経て公開、その後、主要な知見がエビデンスとして活用される。臨床解析と異なり、RWD解析では、プロセスは比較的シンプルだ。だが、第三者による監視が行き届かない懸念もある。最近では、複数の論文を統合して解析するメタ解析も登場し、世界的にRWD解析からのRWE創出が活発化している。
データのばらつき、膨大な量……AIで解決するRWE創出の課題
塩野義製薬が開発したAI-SASは、もともと臨床試験の効率化を目的としていたが、RWE創出への応用にも挑戦している。その理由について、塩野義製薬の吉田祐樹氏(データサイエンス部 データサイエンス1グループ グループ長)は「国内外でRWDの種類が増え、利用環境も整いつつあること、さらにRWD解析に基づく論文の数が増えていることを重視した」と語る。
同社の米田卓司氏(データサイエンス部データサイエンス1グループ)も「塩野義製薬では年間10本近くのRWE論文を発表しており、社内リソースが逼迫(ひっぱく)している。現状のままでは対応が困難になるため、AIの力を活用しようと考えた」と説明する。
RWE創出の中心はメディカルアフェアーズ部門だが、社内でのRWD需要はそれにとどまらない。プロトコール作成や市場投入後の調査、開発薬の市場価値評価など、研究開発以外のマーケティングや経理部門でも活用が求められる。北西由武氏(理事、データサイエンス部長)は「薬の開発に直接関わらなくても、RWEは上市後の薬の価値のアップデート(育薬)に不可欠であり、患者や社会の利益につながるなら、他社にも提供すべきだ」と述べ、AI-SASと同様に社外提供の方針を明かした。
一方で、RWDの活用には多くの課題がある。臨床試験で使われてきたAI-SASの仕組みをそのままRWD解析に流用することは容易ではない。最大の課題はデータ形式のばらつきだ。複数のプロバイダーから匿名化されたRWDを購入する場合、同じ薬剤のレセプトであっても項目名が異なることがある。また、臨床試験では数千例程度の症例を扱うのに対し、RWDデータベースでは1000万例を超えるケースもあり、解析データセット(ADS)の作成には膨大なリソースが必要となる。さらに、解析資料の種類や形式も研究ごとに異なるため、学習データの整備や解析手法にも工夫が求められた。
製品開発の2本柱「RWD標準化」と「RWD解析の準自動化」
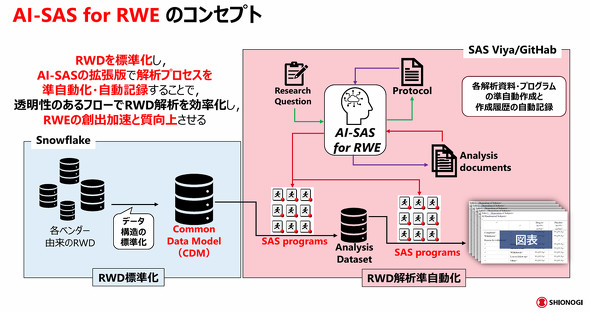
米田氏がAI-SAS for RWE開発で採用したアプローチは、(1)データのフォーマットを整備する「RWD標準化(Common Data Model)」、(2)解析プロセス全体を効率化する「RWD解析の準自動化」の二本柱だ。
まずRWDの標準化においては、OMOP CDM規格を採用した。これは世界中のRWDで使用実績があり、将来的なコード変換の拡張にも対応可能であるためだ。RWDベンダーから提供されるデータは全て、標準化された構造化データに変換して利用する。ただし、完全にOMOP CDMに変換することは難しいため、オリジナルの部分も追加できる方針としている。
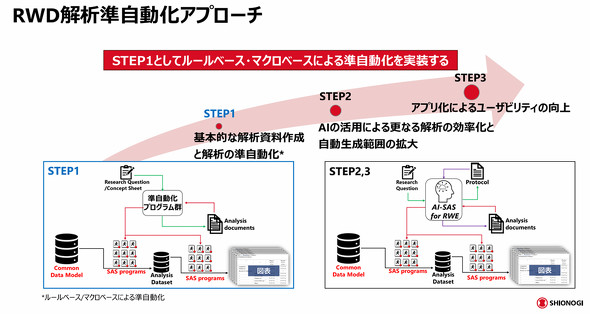
RWD解析の準自動化については、段階的に仕組みを整備している。ステップ1では、ルールベースの手法によって解析プロセスを準自動化した。具体的には、簡単な解析条件を記載したコンセプトシートから解析文書を作成し、その文書に基づいてプログラムを生成するフローを実装した。ステップ2以降では、AIを活用して自動化の範囲をさらに拡大する計画だ。
このハイブリッドアプローチは、テクノロジーを適材適所で活用することを意識した結果だ。吉田氏は「RWDの種類は数百に上る。全てをルールベースで処理するには数百通りのルールを定義する必要があり現実的ではない。一方で、ルールベースで処理できる部分を生成AIに任せるだけでは効率的でない。両者の使い分けが重要だ」と説明する。米田氏も「生成AIは便利だが、最終的には人間による確認が不可欠だ。ステップ1で骨格を整え、ステップ2以降で生成AIなどを使ってさらにブラッシュアップする」と語った。
社内で学び、外部へも展開、塩野義製薬の次世代解析ツール
塩野義製薬では既に「AI-SAS for RWE」を社内で活用し始めている。北西氏は「従来、このようなタスクは担当者ごとにゼロベースで進める必要があり、負担が大きかった」と指摘する。AI-SAS for RWEを使えば、ざっくりとした出力結果を短時間で得られ、人間による確認・ブラッシュアップは必要だが、作業プロセスは大幅に簡素化される。
吉田氏は「タスクはデータ理解から始まる。RWD標準化(Common Data Model)がなければ、国内外のデータベースを確認し、どのようなデータが含まれているかを理解するだけで多くの時間がかかる」と説明する。北西氏も「この作業を実行できる人材は非常に限られており、組織全体で学びながら進めている。ざっくりでも結果を出せるツールには教育的効果も期待できる」と補足する。
さらにステップ2に向けて、一部の処理では生成AIも活用されている。ルールベースと生成AIを使い分け、人間が必ず関与する「Human in the Loop」の体制を整備中だ。AI-SAS for RWEが支援する準自動化プロセスは、米FDAガイドライン準拠のプロトコールを含む各種文書作成をカバーし、作業時間の少なくとも50%以上の削減が見込まれる。臨床試験用AI-SASと同様に、社外への有償提供も計画されている。
既存のAI-SASはSASと共同で売り切りモデルとして提供されているが、AI-SAS for RWEは定期的なメンテナンスが必要となる。北西氏率いるデータサイエンス部では、まず社内利用の促進を優先しつつ、ステップ2以降の実装を進め、新たなパートナーシップの確立に取り組む方針だ。
Copyright © ITmedia, Inc. All Rights Reserved.
アイティメディアからのお知らせ
人気記事ランキング
- Claude拡張機能にCVSS10.0の脆弱性 現在も未修正のため注意
- ホワイトハッカーが明かす「ランサムウェア対策が破られる理由」と本当に効く防御
- 2026年はAGIが“一部実現” AIの革新を乗りこなすための6つの予測
- 7-Zipの偽Webサイトに注意 PCをプロキシノード化するマルウェア拡散
- 一気読み推奨 セキュリティの専門家が推す信頼の公開資料2選
- 「SaaSの死」騒動の裏側 早めに知るべき“AIに淘汰されないSaaS”の見極め方
- 米2強が狙う“AI社員”の普及 Anthropicは「業務代行」、OpenAIは「運用プラットフォーム」
- Fortinet、管理サーバ製品の重大欠陥を公表 直ちにアップデートを
- NTTグループは「AIがSI事業にもたらす影響」をどう見ている? 決算会見から探る
- LINE誘導型「CEO詐欺」が国内で急増中 6000組織以上に攻撃