免疫学に革命的進歩 暴走抑える「制御性T細胞」とは ノーベル生理学・医学賞で話題
ノーベル生理学・医学賞に輝いた大阪大特任教授の坂口志文氏が発見した「制御性T細胞」は、免疫が暴走して自分の体を攻撃するのを防ぐ大切な役割を持つ。長年の謎だった、その仕組みを解明したことで、免疫学に革命的な進歩をもたらした。
免疫は体内に侵入した細菌やウイルスなどの異物を自分と区別して攻撃し、体を守る仕組みだ。免疫を担う細胞は白血球の一種で、リンパ球やマクロファージなど多くの種類があり、連携して働いている。
リンパ球の一種であるT細胞は、細菌などに感染した細胞を発見して排除する役割を持つ。異物を攻撃する抗体を作るよう指令を出すヘルパーT細胞や、その指令で攻撃を行うキラーT細胞などが知られていた。
ところが、自分を守るはずのT細胞が、自分自身を攻撃する「自己免疫」が起きてしまう病気がある。難病の多発性硬化症や、血糖値を下げるインスリンを作る細胞が壊れる1型糖尿病などの自己免疫疾患だ。
なぜ、健康な人では自己免疫が起きないのか。この謎を解き明かしたのが、坂口氏による制御性T細胞の発見だ。
坂口氏は米国留学中の1985年、マウスの実験でT細胞の一部を取り除くと、自己免疫疾患が起きることを発見。取り除いた細胞の中に免疫を抑える細胞が存在すると提唱し、これを制御性T細胞と命名した。
当時の学界では、免疫を抑える細胞は存在しないという考え方が支配的だった。坂口氏が主張した細胞も実体が不明だったため、懐疑的な見方が多かった。
だが、坂口氏は、その後も研究を続け、帰国後の91年に細胞の正体を突き止めた。マウスを使った実験で、ごく一部のT細胞の表面に「CD25」という特殊なタンパク質が存在することを発見。このタンパク質を持つT細胞を取り除くと、甲状腺や腸などでひどい炎症が生じ、自己免疫が起きることを見いだした。
さらに、このタンパク質を持っているT細胞を少しでも移植すると、症状は収まることを確認。CD25を目印にして、自己免疫を防ぐ制御性T細胞が実在することを証明し、7年に論文発表した。
京都大教授となった後、15年には制御性T細胞の働きに不可欠な「Fox(フォックス)p3」という遺伝子を特定した。遺伝性の免疫疾患「IPEX(アイペックス)症候群」の原因として知られる遺伝子だ。これを組み込んだT細胞を自己免疫疾患のマウスに移植すると完治することから、この遺伝子が制御性T細胞の機能にスイッチを入れる重要な役目を持つことを明らかにした。
制御性T細胞の分子生物学的な根拠を示したことで坂口氏の発見は揺るぎないものとなり、免疫学の歴史に残る業績となった。
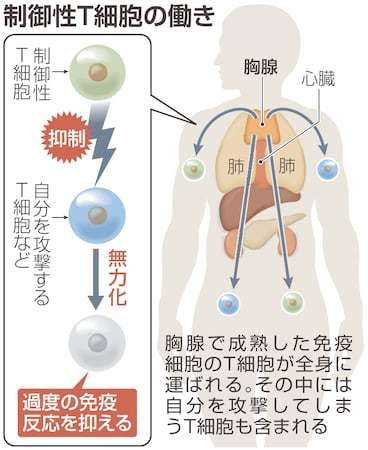
全てのT細胞は、心臓の上部にある胸腺で成熟し、血管やリンパ管などを通じて全身に運ばれる。自分を攻撃するT細胞の多くは胸腺にいる間に破壊され、血管などにはその侵入を防ぐ働きもある。しかし、自己攻撃性のT細胞を完全に除去するのは難しい。
制御性T細胞は体内を見回り、防御機構をすり抜けてきた自己攻撃性のT細胞を見つけて、無力化させる役割を持つ。数はT細胞全体の1割程度と少ないが、重要なパトロール部隊として体を守っている。
関連リンク
- 「一人で戦えるか」と幹事長に突き放され神にすがる石破首相の精神 新潮が疑う 花田紀凱 花田紀凱の週刊誌ウォッチング(1044)
- いまも「平民」になり切れていない 南北朝時代から続く家「お墓の管理が結構大変です」 話の肖像画 伏見記念財団代表理事・伏見博明<29>
- 愛妻は3つ年下のシャンソン歌手 ステージでバラを…そのときの盛り上がりといったらもう 話の肖像画 元米チョイス・ホテルズ副社長・藤村延魚<14>
- 【動画】野口健さん「なぜ北海道知事は中止命令出さないのか」と憤りあらわ 釧路メガソーラー視察
- 「さっきまで元気だったのに」と同僚絶句 目の前で40代男性が死亡 歓送迎会で脳出血 脳卒中サバイバー記者
copyright (c) Sankei Digital All rights reserved.
Special
PR