性能5倍の「蓄電池」、自動車変えるリザーバ型:蓄電・発電機器(4/5 ページ)
金属硫化物電極の反応機構を解明
カチオンが移動するリザーバ型蓄電池にはハロゲン化物を用いるもの以外に、硫化物を用いるものがある。図3で「M-S」と示したタイプだ。以下のような反応で充放電する。
4Li +アモルファスTiS4 ↔ Li4TiS4
これまでLiS系はサイクル寿命が非常に短かったのだという(図5左)。これは放電時に正極材料の硫黄が電解液に溶け出してしまうためだ。
そこで金属(上の反応式ではチタン)と共有結合するような方策を講じた。安定した充放電が可能になり、おそらくチタンと硫黄がアモルファス構造を採っていると予測できたが、確認する手段がない(性能を改善する糸口がない)。
「アモルファス構造では、短い周期構造がないため、通常のX線回折では観察できなかった。そこで、大型放射光施設Spring-8の高エネルギー回折を用いて、長い範囲の秩序構造の情報を得た。放電が終わったLi4TiS4と充電が完了したTiS4の電極の全体像を比較することにより、図5左の下に示した状態を採ることを確認できた」(同氏)。
多電子移動が可能なハロゲン化蓄電池
3つ目の開発成果は、アニオンが移動するリザーバ型蓄電池に関するもの。高いエネルギー密度を狙っているものの、リチウムは登場しない。
図6に示したように負極に金属ハロゲン化物、正極に別の金属を置く。両極間を移動するのはハロゲンのイオンだ。例えば、フッ化物イオン(F−)を用いたときは、次のような反応で充放電する。ランタン(La)の価数が3つ、銅(Cu)の価数が2つ変化しており、効率よく電子を扱うことができる。多電子移動が可能であるため、エネルギー密度の高い蓄電池として期待できそうだ。
2LaF3 + 3Cu ↔ 2La + 3CuF2
Copyright © ITmedia, Inc. All Rights Reserved.
人気記事トップ10
- ペロブスカイト太陽電池を高性能化する添加剤 発電効率と耐久性を改善
- 太陽光発電所をFIP転し蓄電池も併設 需給調整市場にも対応する国内初の事例
- 国内のマイクログリッド構築市場 2040年度までに810億円規模に
- 費用負担や需要創出が課題に 「SAF(持続可能な航空燃料)」導入促進に向けた基本方針
- 太陽光発電・風力発電の環境規制を厳格化 環境アセスメント制度を見直しへ
- 国内の蓄電所ビジネス市場 2030年度に4240億円規模に
- 太陽光発電市場は本当に“逆風”の中なのか? 経産省・環境省・国交省が語る2026年の展望
- 約定単価・総額は過去最高 29年度対象の容量市場メインオークション約定結果
- 太陽光パネルの新たなリサイクル制度 第一段階では「大量排出者」を義務対象に
- 重ね貼り施工が可能な「ペラペラ太陽光」 リパワリング向けに
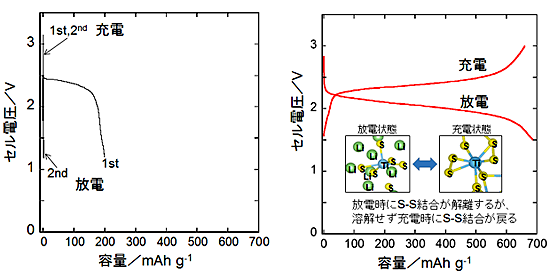 図5 硫黄電極の充放電挙動 左:2回目の充放電で既に容量が0近くまで落ちている。右:アモルファス構造を採る金属硫化物電極の充放電の挙動と、微視的な構造。出典:NEDO、京都大学
図5 硫黄電極の充放電挙動 左:2回目の充放電で既に容量が0近くまで落ちている。右:アモルファス構造を採る金属硫化物電極の充放電の挙動と、微視的な構造。出典:NEDO、京都大学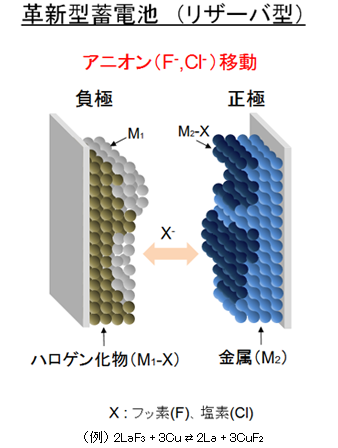 図6 アニオンが移動するリザーバ型蓄電池 フッ化物イオンや塩化物イオンが電荷を運ぶ。出典:NEDO、京都大学
図6 アニオンが移動するリザーバ型蓄電池 フッ化物イオンや塩化物イオンが電荷を運ぶ。出典:NEDO、京都大学


