なぜなぜ燃料電池、実は「電池」ではないのでは?:発電の仕組み(4)(1/2 ページ)
水素やメタンから直接電力が得られる燃料電池。国内では防災機器やキャンプ用品、「エネファーム」、燃料電池車などで使われており、珍しい装置ではない。だが、電力が生まれる仕組みは火力発電や太陽電池とは異なる。水素ガスは使うが、ガスエンジンとも違う。短期連載第4回では燃料電池を解説する。
「燃料電池」は、電池ではあるがケータイに入っているリチウムイオン蓄電池とは違う。第1回で紹介した太陽電池とも違う。ではどう違うのか。
蓄電池はあらかじめ入力した電力を内部に保存して、入力した分だけ後から取り出すことができる装置だ。太陽電池は光のエネルギーを電力に変換する装置であり、電力を蓄えることはできない。
燃料電池は電力を蓄えることができない点では太陽電池と似ている。太陽電池と異なるのは光ではなく、水素などを入れると、空気中の酸素と反応して電力を生み出すところだ。
このような装置が生まれた経緯は何だったのか。そもそもの発端は、太陽光発電の原理「光電効果」が発見されたときとほぼ同時期の出来事にさかのぼる。
動作する燃料電池を最初に試作したのは英国ウェールズの裁判官だったグローブ(William Robert Grove)だ。彼は1837年の新婚旅行の際に、科学研究を始めようと思い立ち、早速、一次電池に関する論文を書き上げる。彼の発明したグローブ電池は一時、電信技術を支えるほど広く使われた。電池の歴史に必ず登場する発明だ。1842年には一種のエネルギー保存則を発見し、酸素と水素から電力を生み出す燃料電池を作り上げた。彼は燃料電池の原理をエネルギー保存則で説明して見せた。
グローブの燃料電池は希硫酸に白金の棒を浸し、水素と酸素を用いるタイプだった。試験管を逆向きにしたような管の中央に白金線を通し、試験管の上部に酸素を入れる。その後、試験管の下部を希硫酸が入ったビーカーに浸す。同様に上部に水素が入った試験管もビーカーに浸す。これだけで燃料電池として動作する。1組では電圧が低いため、グローブの燃料電池を使うときは、ビーカーを複数用意して直列につないでいた(図1)。
なお、図1中のox、hyはそれぞれ酸素(Oxygen)と水素(Hydrogen)を表している。
宇宙計画で日の目を見る
グローブの後、溶けた炭酸塩を使う燃料電池(現在のMCFC)などさまざまな燃料電池の開発が英国、米国、ドイツ、ソ連で進む。英国のベーコン(Francis Thomas Bacon)が開発した燃料電池は1959年にトラクター用電源として実用化されている。
燃料電池が広く知られるようになったのは米航空宇宙局(NASA)が有人宇宙飛行に適した技術だと判断したためだ。候補に挙がった原子力電池や一次電池、太陽電池はそれぞれ危険性、容量、体積に難があり、有人宇宙飛行には適していなかった。
燃料電池は1965年から始まったジェミニ計画で最初に採用され、アポロ計画で本格的に使われた。1969年に初めて月着陸に成功したアポロ11号にも搭載されている。最大出力は2.3kWだった。アポロ計画で使われた燃料電池はベーコンが開発した方式を採っている。
なぜ電気が生まれる
燃料電池は化学反応を利用した発電機ともいえる。ただし、炎を上げて燃えるような現象は全く起きていない。水素ガスを酸素ガスと混合して燃焼させると2800度の高温が発生する。これほどの高温では発電用ガスタービンも耐えられない。溶接技術かロケットエンジンにしか使えない。当然電池にはならない。
水素と酸素が化合して水ができる反応を複数の段階に分離し、別々の場所で異なる反応が起きるようにすることで、電子の流れ(電流)を取り出すのが燃料電池の基本的な仕組みだ。こうすると、直接燃焼させた場合よりも電力として取り出せるエネルギーが増える。つまり効率が高くなる。
以下では100度以下で反応する固体高分子形燃料電池(PEFC)と、最大1000度にも達する固体酸化物形燃料電池(SOFC)の仕組みを解説しよう。
PEFCは、携帯型の燃料電池や、従来型のエネファームなどに広く使われている。燃料電池の台数では最も普及しているタイプだろう。小型軽量化に向き、起動時間が短いことが特徴だ。
燃料電池の反応を支えるのは水素であるため、水素を直接使う他、天然ガス(メタン)やLPG(液化石油ガス)、メタノールなどを原燃料とし、機器内部で改質して水素を取り出す方式の機器も多い。エネファームは都市ガス(メタン)を使うため、内部に改質器が付いていて、メタン(CH4)を水素と二酸化炭素に変えている。二酸化炭素は放出し、水素だけを発電に使う。
CH4+O2→CO2+2H2
次世代自動車として注目されている燃料電池車(FCV)もPEFCを使っている。実用化されているほとんどの燃料電池車は水素スタンドで水素をタンクに充填し、内蔵する燃料電池で電力を生み出して走行用モーターを回している。
PEFC内部で進む化学反応を図2にまとめた。図2を見ると、燃料電池が主に3つの部分からできていることが分かる。実際には固体高分子膜と2つの極は一体化している。
中央にある固体高分子膜には、水を伴った水素イオン(H+)だけを通すフッ素樹脂系イオン交換膜が使われている。米DuPont(デュポン)が開発したイオン交換膜「ナフィオン」がなければPEFCの開発は進まなかっただろう。
燃料極(アノード)と書かれている部分は外部から水素ガスを受け取って、水素イオンと電子に分解する部分だ。電子は燃料電池外部に電流として取り出せる。
空気極(カソード)は固体高分子膜を通過してきた水素イオンと空気中の酸素、負荷を通過してきた電子が合わさって水になる反応が起きる部分だ。
燃料極と空気極には「触媒」がある。なぜだろうか。それはPEFCが液体の水がある状態でしか動作しないため、100度以下に保つ必要があるからだ。100度以下では極での化学反応が遅くなる。特に空気極の反応を加速する必要がある。空気極の白金(Pt)触媒の量を減らし、触媒の寿命を長くする研究開発が進行中だ。
Copyright © ITmedia, Inc. All Rights Reserved.
人気記事トップ10
- 系統用蓄電池の接続手続きの規律を強化 順潮流側ノンファーム型接続に「計画値制御」も導入へ
- 住宅用蓄電システムのセキュリティ対策を強化 オムロンが「JC-STAR」認証を取得
- 水素燃料電池で動く油圧ショベルを実際の工事現場に 国内初の実証実験
- 太陽光発電の未来を占う試金石に──再エネ「FIP転換」の実像と留意点
- 系統用蓄電所に疑似攻撃 パナソニックがサイバーセキュリティ実証
- 太陽光発電所をFIP転し蓄電池も併設 需給調整市場にも対応する国内初の事例
- ペロブスカイト太陽電池を高性能化する添加剤 発電効率と耐久性を改善
- 家庭用蓄電池でデマンドレスポンス 九州電力とシャープが実証
- 太陽光パネル角度を自動制御 徳島県にソーラーシェアリング発電所
- 国内のマイクログリッド構築市場 2040年度までに810億円規模に
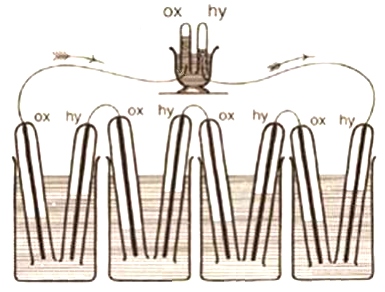 図1 グローブが発明した最初の燃料電池。出典:米Department of Energy
図1 グローブが発明した最初の燃料電池。出典:米Department of Energy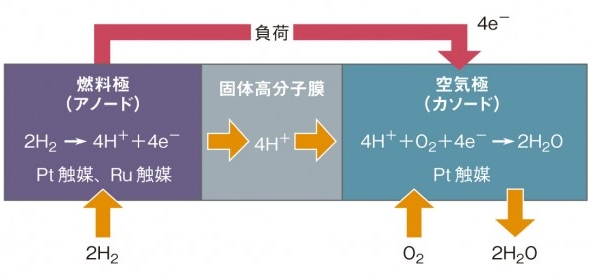 図2 固体高分子形燃料電池(PEFC)の仕組み
図2 固体高分子形燃料電池(PEFC)の仕組み


